KN564 – Adjuvan Renal Hücreli Karsinom-test


KEYTRUDA®, nefrektomi sonrası RCC’li uygun hastalarda adjuvan tedavi olarak onaylanan İLK ve TEK immünoterapidir.1-11
KEYTRUDA®, monoterapi halinde, berrak hücreli renal karsinomu olan yetişkinlerin adjuvan tedavisi için aşağıda belirtilen risk faktörlerinden en az birini karşılayan hastalarda 1 yıl süreyle kullanımı endikedir:
– Patolojik evresi pT2N0M0 olup, grade 4 veya sarkomatoid özellikli olan hastalar
– Patolojik evresi pT3-4N0 olan ya da T evresinden bagımsız patolojik bölgesel nodal tutulumu olan herhangi grade hastalar
– M1 olup nefrektomi ve nefrektomiyle eş zamanlı ya da 1 yıl içinde komplet metastazektomi yapılan hastalar

KEYTRUDA®, 3 ana kılavuzda nefrektomi sonrası RCC’li uygun hastalara yönelik olarak önerilen bir adjuvan tedavi seçeneğidir.3,12,13
KEYNOTE-564 çalışması
KEYNOTE-564 çalışması, rezeke edilmiş RCC’li bazı hastaların adjuvan tedavisi için dönüm noktası niteliğinde, çok merkezli, randomize, çift kör, plasebo kontrollü bir klinik çalışmadır.2
Orta-yüksek veya yüksek RCC nüks riski veya M1 NED olan hastalara yönelik çok merkezli, randomize, çift kör, plasebo kontrollü bir çalışma.2
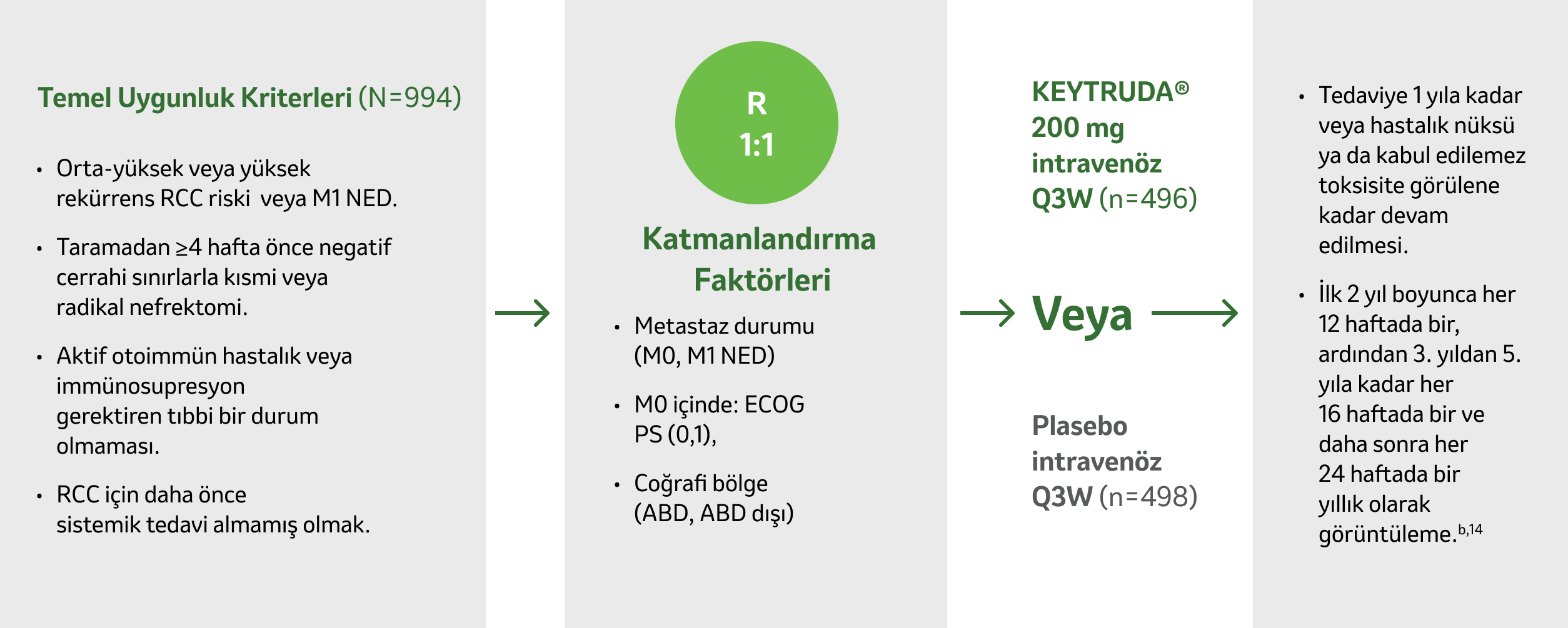
Birincil sonlanım noktası: Araştırmacı tarafından değerlendirilen hastalıksız sağkalım (DFS).2
İkincil sonlanım noktası: Genel sağkalım.2
Medyan takip süresi: 24,1 ay (aralık: 14,9-41,5 ay).2
aM1 NED gönüllülerinde solid, izole, yumuşak doku metastatik lezyonlarının tam rezeksiyonu vardı.1
bGörüntüleme randomizasyondan itibaren başlamıştır.14
ECOG PS: Doğu Kooperatif Onkoloji Grubu performans durumu; M0: uzak metastaz yok; M1: uzak metastaz;
NED: hastalık kanıtı yok; Q3W: her 3 haftada bir; R: randomizasyon; RCC: renal hücreli karsinom; ABD: Amerika Birleşik Devletleri.
Çalışmadaki toplam hasta sayısı 994’tüc,1,2,14

cBaşlangıç özellikleri ve demografik özellikler KEYTRUDA® ve plasebo kolları arasında genel olarak benzerdi.
ECOG PS: Doğu Kooperatif Onkoloji Grubu performans durumu; M1: uzak metastaz; N0: bölgesel lenf nodülü metastazı yok; NED: hastalık kanıtı yok.

DFS: Birincil sonlanım noktası
- KEYNOTE-564 çalışmasında DFS, randomizasyondan ilk belgelenmiş lokal veya uzak RCC nüksüne veya herhangi bir nedene bağlı ölüme kadar geçen süre (hangisi önce gerçekleşirse) olarak tanımlanmıştır.2
- DFS, EMA tarafından klinik çalışmaların birincil sonlanım noktalarından biri olarak kabul edilmektedir.15
- DFS, hastaların kanser belirtileri olmadan ne kadar süre yaşadıklarını ölçer.16

OS: İkincil sonlanım noktası
- KEYNOTE-564 çalışmasında OS, randomizasyondan herhangi bir nedenle ölüme kadar geçen süre olarak tanımlanmıştır.2
- EMA tarafından faydalar ve zararlar arasında pozitif bir denge kurulması için en önemli etkililik sonlanım noktası olarak kabul edilmiştir.15
DFS: hastalıksız sağkalım; EMA: Avrupa İlaç Ajansı; OS: genel sağkalım; RCC: renal hücreli karsinom.

M0: uzak metastaz yok; M1: uzak metastaz; N0: bölgesel lenf nodülü metastazı yok; NED: hastalık kanıtı yok; N1: bir lenf nodülü metastazı pT: patolojik evre.

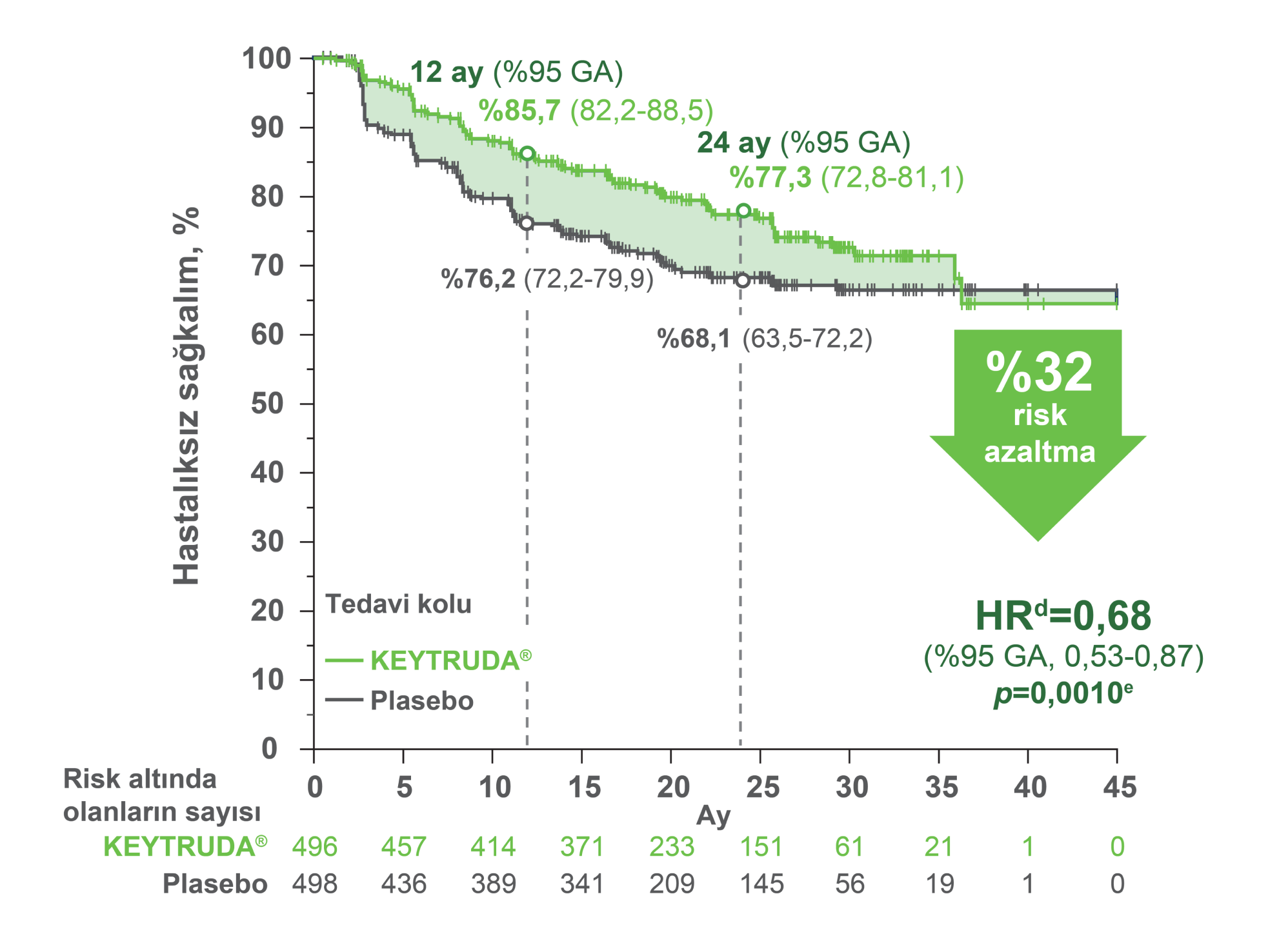
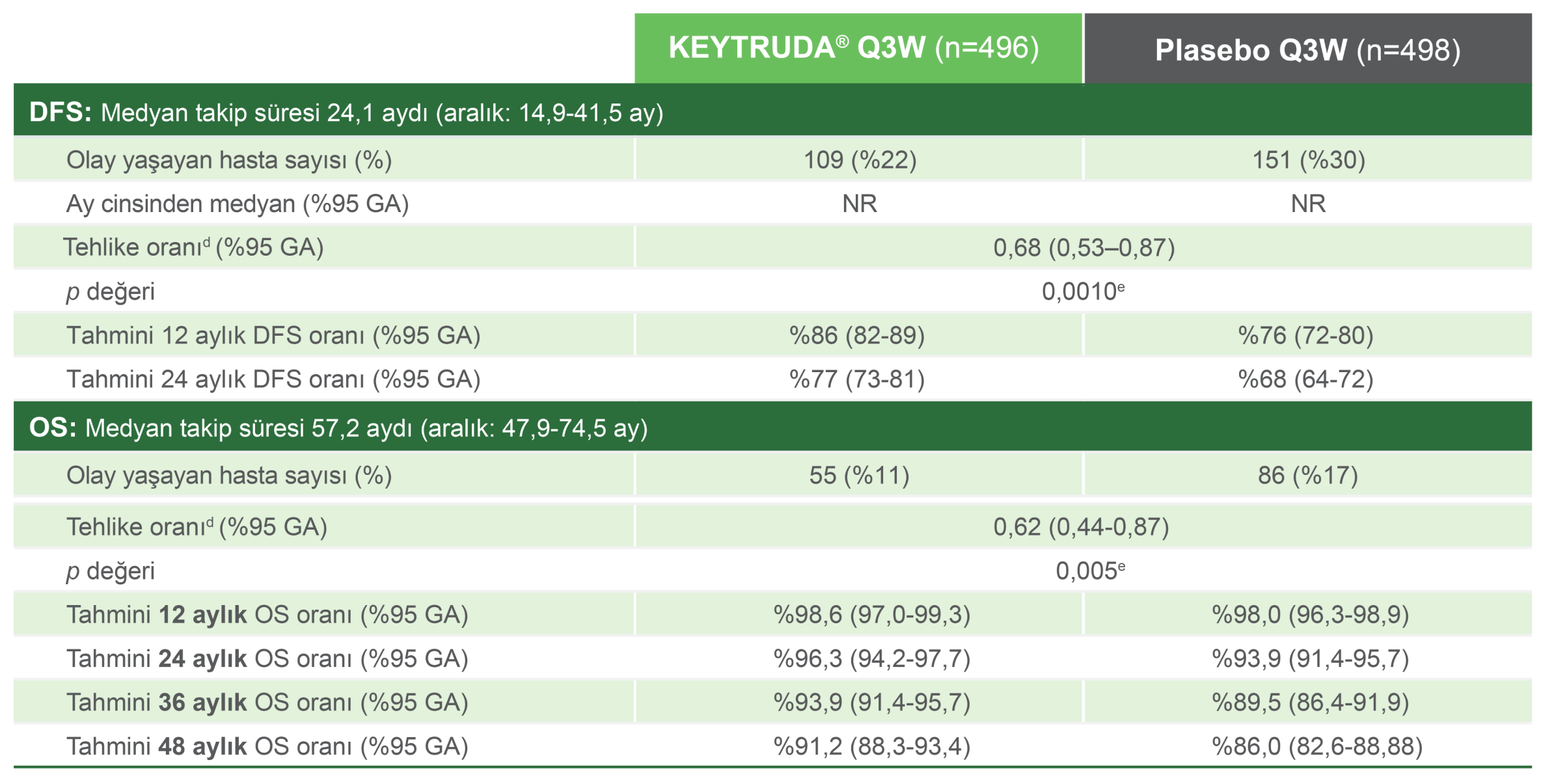
KEYTRUDA®, adjuvan tedavi olarak 994 hasta ile yapılan Faz 3 çalışmasına göre hastalıksız sağkalımda istatistiksel olarak anlamlı bir iyileşme göstermiştir.1,2,14

Plasebo ile karşılaştırıldığında KEYTRUDA® ile hastalık nüksü, metastaz veya ölüm riskindeki azalma oranı, HRd: 0,68 (%95 GA, 0,53-0,87; p=0,0010e).
Gözlemlenen olaylar: KEYTRUDA® ile 109/496 (%22) ve plasebo ile 151/498 (%30).
Medyan DFS: KEYTRUDA® veya plasebo için ulaşılmadı.

Tahmini 12 aylık DFS oranları:
KEYTRUDA® ile %86 (%95 GA, 82-89) ve plasebo ile %76 (%95 GA, 72-80).

Tahmini 24 aylık DFS oranları:
KEYTRUDA® ile %77 (%95 GA, 73-81) ve plasebo ile %68 (%95 GA, 64-72).

Tahmini 48 aylık DFS oranları:
KEYTRUDA® ile %65 (%95 GA, 60-69) ve plasebo ile %57 (%95 GA, 52-61).
GA: güven aralığı; DFS: hastalıksız sağkalım.
Medyan hasta takip süresi: 24,1 ay (aralık: 14,9-41,5 ay).2
dHR, katmanlandırılmış Cox orantılı tehlike modeline dayanmaktadır.
eKatmanlandırılmış log-rank testine dayalı eP değeri.
GA: güven aralığı; DFS: hastalıksız sağkalım; HR: tehlike oranı.
Medyan hasta takip süresi: 57,2 ay (aralık: 47,9-74,5 ay).17
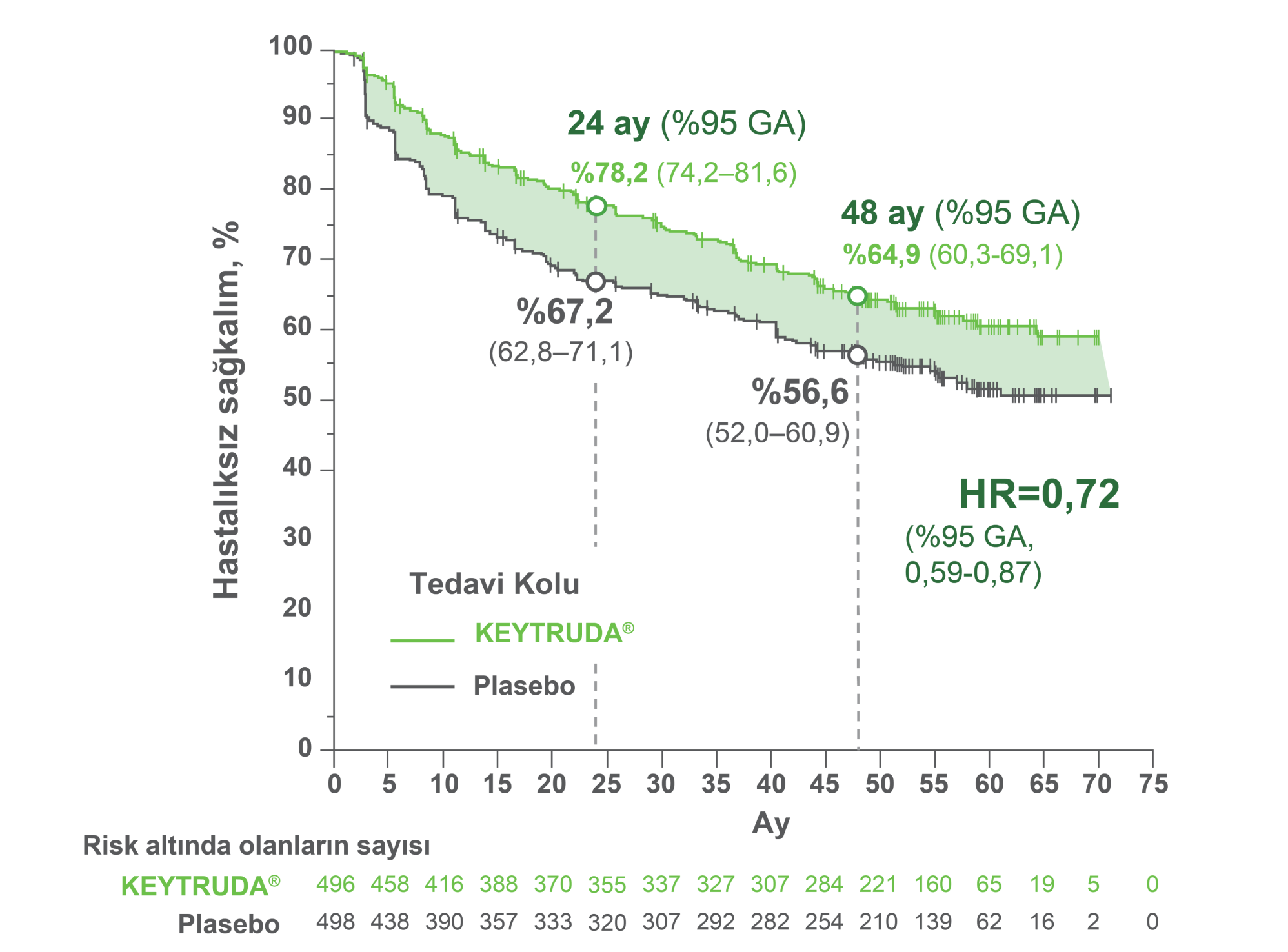
SINIRLAMALAR: DFS için istatistiksel testler Birinci İnterim Analizde tamamlanmıştır ve bu nedenle Üçüncü İnterim Analizde resmi bir istatistiksel test yapılmamıştır. Hiçbir sonuç çıkarılamaz.
GA: güven aralığı; DFS: hastalıksız sağkalım; HR: tehlike oranı.

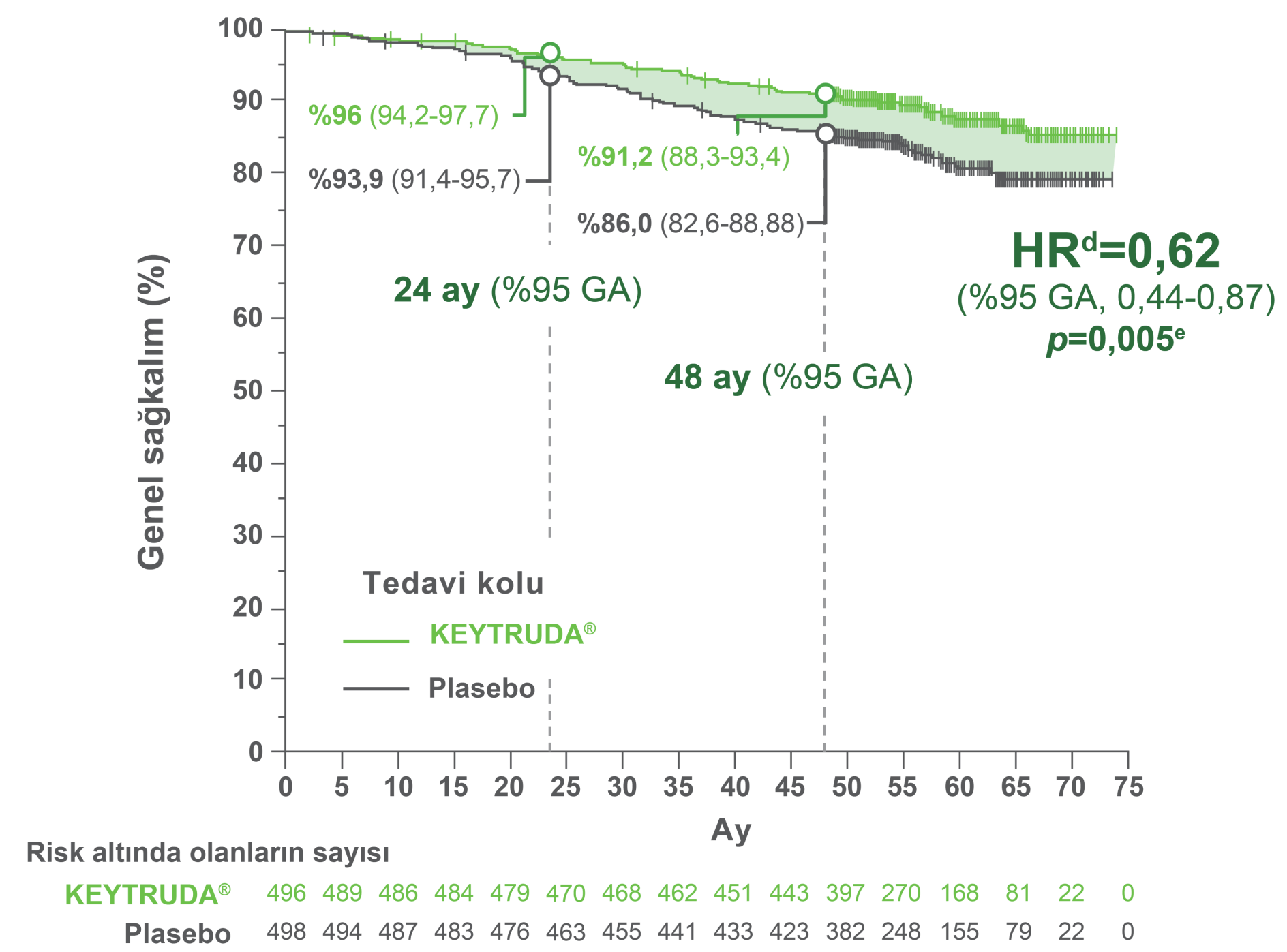
KEYTRUDA®, ameliyattan sonra yüksek nüks riski taşıyan RCC hastalarında adjuvan tedavi olarak OS’de istatistiksel olarak anlamlı bir iyileşme göstermiştir.17

plaseboya kıyasla KEYTRUDA® ile ölüm riskindeki azalma oranı
HR: 0,62 (%95 GA, 0,44-0,87; p=0,005)
48 aylık OS oranı
Gözlemlenen olaylar: KEYTRUDA® ile 55/496 ve plasebo ile 86/498.

24 aylık OS oranı:
KEYTRUDA® ile %96,3 (%95 GA, 94,2-97,7) ve plasebo ile %93,9 (%95 GA, 91,4-95,7).

48 aylık OS oranı:
KEYTRUDA® ile %91,2 (%95 GA, 88,3-93,4) ve plasebo ile %86,0 (%95 GA, 82,6-88,8).
GA: güven aralığı; OS: genel sağkalım.
Medyan takip süresi: 57,2 ay (aralık: 47,9-74,5 ay).17
dHR, katmanlandırılmış Cox orantılı tehlike modeline dayanmaktadır.
eKatmanlandırılmış log-rank testine dayalı eP değeri.
GA: güven aralığı; HR: tehlike oranı; OS: genel sağkalım.
dHR, katmanlandırılmış Cox orantılı tehlike modeline dayanmaktadır.
eKatmanlandırılmış log-rank testine dayalı eP değeri.
GA: güven aralığı; DFS: hastalıksız sağkalım; NR: ulaşılmadı; OS: genel sağkalım; Q3W: 3 haftada bir.
KEYTRUDA® ile medyan tedavi süresi 11,1 aydı (aralık: 0,0-14,3 ay), plasebo ile ise 11,1 aydı (aralık: 0,0-15,4).

Hastalar, hastalık nüksü veya kabul edilemez toksisite görülene kadar en fazla 1 yıl süreyle KEYTRUDA® aldı.
Uygulanan tedaviye dayalı popülasyonda, KEYTRUDA® grubundaki hastaların %20,7’si ve plasebo grubundaki hastaların %2,0’si advers olaylar nedeniyle tedaviyi bıraktı.
KEYTRUDA® ile en sık görülen advers reaksiyonlar (≥%20) yorgunluk (%29,7), ishal (%25,4), kaşıntı (%22,7), artralji (%22,1), hipotiroidizm (%21,1) ve döküntü (%20,1) oldu.
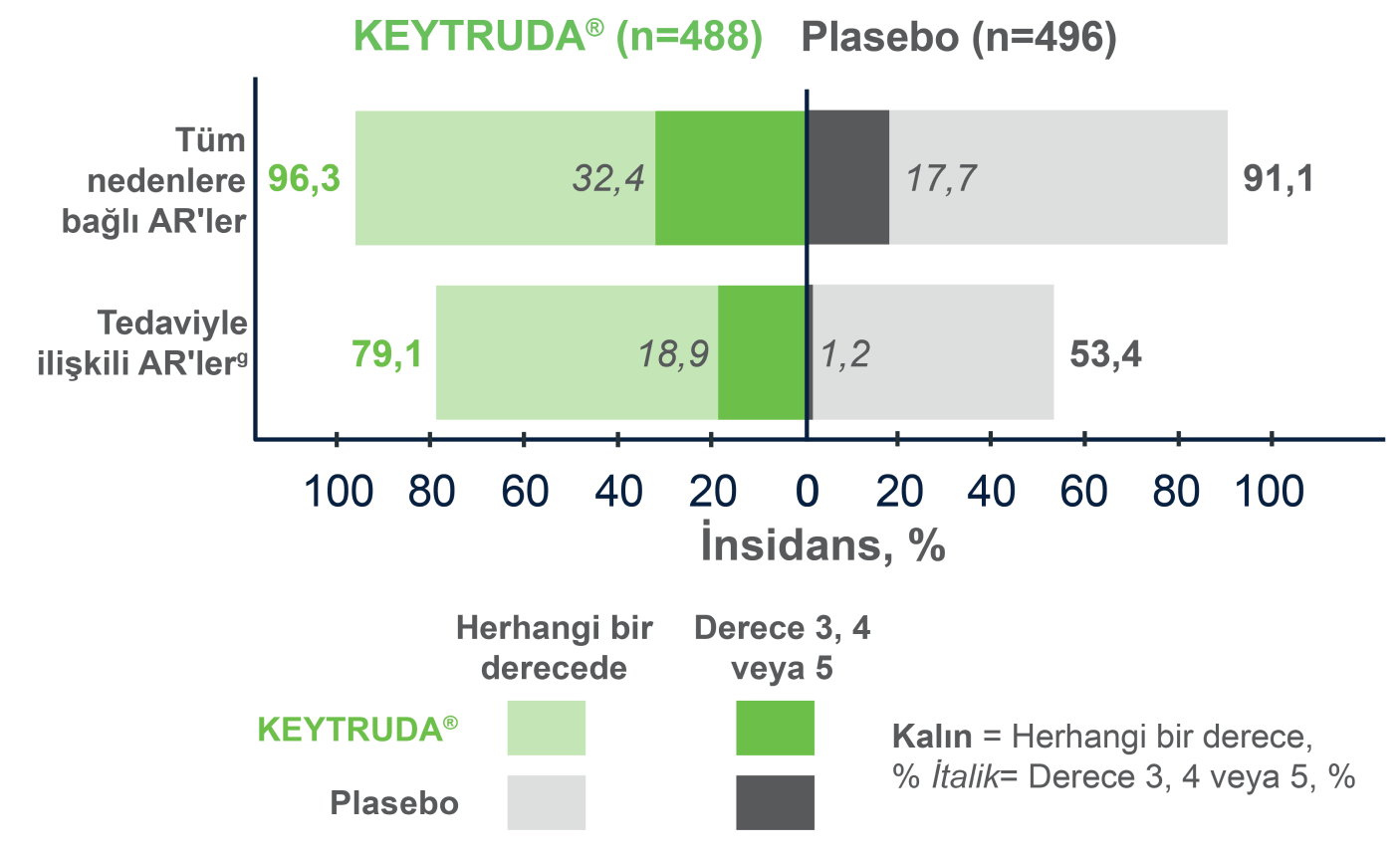

Herhangi nedene bağlı AR’ler2
- AR nedeniyle bırakma: KEYTRUDA® için 101/488 (%20,7) ve plasebo için 10/496 (%2,0).
- AR nedeniyle ölüm: KEYTRUDA® için 2/488 (%0,4) ve plasebo için 1/496 (%0,2).
- Ciddi AR: KEYTRUDA® için 100/488 (%20,5) ve plasebo için 56/496 (%11,3).
- Ciddi AR nedeniyle bırakma: KEYTRUDA® için 49/488 (%10,0) ve plasebo için 5/496 (%1,0).

Tedaviyle İlişkili AR’ler2
- AR nedeniyle bırakma: KEYTRUDA® için 86/488 (%17,6) ve plasebo için 3/496 (%0,6).
- AR nedeniyle ölüm: her iki grupta 0 hasta.
- Ciddi AR: KEYTRUDA® için 59/488 (%12,1) ve plasebo için 1/496 (%0,2).
- Ciddi AR nedeniyle bırakma: KEYTRUDA® için 37/488 (%7,6) ve plasebo için 0.
fUygulanan tedaviye dayalı popülasyona en az 1 doz KEYTRUDA® veya plasebo alan tüm hastalar dahil edilmiştir. AR’ler randomizasyondan itibaren KEYTRUDA® veya plasebonun kesilmesinden 30 gün sonrasına kadar kaydedilmiştir. Ciddi AR’ler ölümle sonuçlanan, yaşamı tehdit eden, hastaneye yatışla veya mevcut yatışın uzamasıyla sonuçlanan, kalıcı veya önemli sakatlık veya iş göremezlikle sonuçlanan, konjenital bir anomali veya doğum kusuru olan veya araştırmacı tarafından ciddi bir advers reaksiyon olarak değerlendirilen herhangi bir AR olarak tanımlanmıştır. Ciddi AR’ler randomizasyondan itibaren KEYTRUDA® veya plasebonun kesilmesinden 90 gün sonrasına kadar kaydedilmiştir.
gAraştırmacı tarafından değerlendirildiği üzere.
AR: advers reaksiyon.

hHer iki gruptaki hastaların en az %10’unda Derece 4 veya 5 advers reaksiyon meydana gelmemiştir.
AR: advers reaksiyon.
Tek bir ajan olarak KEYTRUDA®’nın güvenliliği, RCC nedeniyle nefrektomi geçirmiş 984 hastaya en fazla bir yıl süreyle her 3 haftada bir intravenöz infüzyon yoluyla 200 mg KEYTRUDA® (n=488) veya plasebo (n=496) uygulanan randomize (1:1) çift kör plasebo kontrollü bir çalışma olan KEYNOTE-564 çalışmasında araştırılmıştır. Çalışma rejiminin medyan süresi pembrolizumab grubunda 11,1 ay (aralık 0,0 ila 14,3) ve plasebo grubunda 11,1 ay (aralık 0,0 ila 15,4) olmuştur. Tedavi edilen popülasyonda pembrolizumab grubundaki hastaların %20,7 si ve plasebo grubundaki hastaların %2,0 si advers olaylar nedeniyle çalışma tedavisini bırakmıştır, bu advers olayların çoğu ciddi değildir.
Pembrolizumab alan hastaların %12,1 inde ve plasebo alanların %0,2 sinde en az bir tedaviyle ilişkili ciddi advers olay görülmüştür.
ALT: alanin aminotransferaz; AST: aspartat aminotransferaz; RCC: renal hücreli karsinom.
KEYTRUDA®100 mg/4 ml iv infüzyonluk çözelti.
▼Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM’a bildirmeleri beklenmektedir. (www.titck.gov.tr; eposta: tufam@titck.gov.tr tel: 0 800 314 00 08; faks: 0 312 218 35 99). Etkin madde(ler): Pembrolizumab konsantrenin her mililitresi 25 mg pembrolizumab içerir. Pembrolizumab Çin hamster over hücrelerinde rekombinant DNA teknolojisiyle üretilen, insanlaştırılmış, monoklonal bir anti-programlı hücre ölümü-1 (PD-1) antikorudur. Ambalajın niteliği ve içeriği: Her karton kutuda 1 flakon bulunur. Her bir 4 ml’lik flakon 100 mg pembrolizumab içerir. Keytruda® 10 ml Tip I renksiz cam flakon içerisinde 4ml konsantre şeklinde sunulur; flakonda gri klorobutil tıpa ve alüminyum kapak ile birlikte lacivert renkte flip-off kapak mevcuttur. Farmasötik Form: İnfüzyonluk çözelti içeren konsantre. Renksiz ile açık sarı arası renkte berrak veya hafifçe opalesan çözelti. Terapötik endikasyonlar: Keytruda®’nın, rezeke edilemeyen veya metastatik malign melanoma tedavisinde daha önce en az bir seri sistemik tedaviden sonra hastalık progresyonu gösteren ECOG performans skoru (PS) 0-1 olan, daha önce PD-1 ve PD-L1 inhibitör tedavisi almayan hastaların tedavisinde progresyona kadar kullanımı endikedir. Keytruda®’nın, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, skuamöz olmayan küçük hücreli dışı akciğer kanseri (KHDAK)’nde EGFR ve ALK mutasyonları bulunmayan, eş zamanlı immunsupresif veya kortikosteroid tedavisi almayan metastatik KHDAK’de, PD-L1 ekspresyonu %50 ve üzerinde olan hastaların birinci basamak tedavisinde progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1, PD-L1 inhibitörleri kullanılamaz. Pembrolizumab tedavisi tıbbi onkologlarca planlanıp uygulanmalıdır. Keytruda®, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, EGFR ya da ALK mutasyonları bulunmayan ve eş zamanlı immünsüpresif veya kortikosteroid tedavisi almayan metastatik skuamöz olmayan KHDAK hastalarının birinci basamak tedavisinde, platin ve pemetrekset kemoterapi rejimi ile kombine olarak progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1 ve PD-L1 inhibitörleri kullanılamaz. Keytruda®, ECOG PS 0-1 olan, yeterli kardiyak, renal ve hepatik fonksiyonları bulunan, aktif beyin metastazı olmayan, eş zamanlı immünsupresif ve kortikosteroid tedavisi almayan, metastatik skuamöz KHDAK hastalarının birinci basamak tedavisinde karboplatin ve paklitaksel veya nab-paklitaksel’den herhangi biri ile kombine olarak progresyona kadar kullanımı endikedir. Tedavi sonu progresyonda diğer PD-1 ve PD-L1 inhibitörleri kullanılamaz. Keytruda®, ECOG PS 0-1 olan, platin içeren kemoterapi esnasında veya sonrasında, ya da platin içeren neoadjuvan veya adjuvan kemoterapi tedavisini takiben 12 ay içerisinde progrese olan lokal ileri evre veya metastatik ürotelyal karsinomlu hastaların tedavisinde monoterapi olarak progresyona kadar kullanımda endikedir. Keytruda®, monoterapi olarak veya platin ve 5-florourasil (5-FU) kemoterapisi ile kombinasyon halinde, ECOG PS 0-1 olan, tümörleri kombine pozitif skor (CPS) ≥ 1 ile PD-L1 eksprese eden erişkinlerde metastatik veya rezeke edilemeyen tekrarlayan nazofarinks dışı skuamöz hücreli baş boyun karsinomu (SHBBK)’nin birinci basamak tedavisinde endikedir. Hastalar eğer küratif kemoradyoterapi almışlarsa küratif tedaviden sonra en az 6 aylık hastalıksız süre geçmiş olmalıdır. Keytruda®, aksitinib ile kombinasyon halinde, Karnofski performans skoru ≥ 70 olan, semptomatik beyin metastazı olmayan, kontrolsüz hipertansiyonu olmayan, IMDC risk kategorisi orta/kötü riskli yetişkin metastatik berrak hücreli renal karsinomlu hastaların birinci basamak tedavisinde endikedir. Keytruda®, otolog kök hücre nakli (OKHN) sonrasında relaps olan veya OKHN için uygun olmayan en az iki basamak tedaviyi takiben nükseden veya refrakter, klasik Hodgkin Lenfoma (cHL)’li 3 yaş ve üzeri pediyatrik ve yetişkin hastaların tedavisinde monoterapi olarak endikedir. Keytruda®, sisplatin ve floropirimidin temelli kemoterapi ile kombinasyon halinde (progresyona dek veya maksimum 35 siklus), tümörleri CPS ≥ 10 ile PD-L1 eksprese eden erişkinlerde, küratif tedaviye uygun olmayan lokal ilerlemiş veya metastatik özofagus karsinomunun veya HER-2 negatif gastroözofageal bileşke adenokarsinomunun birinci basamak tedavisinde endikedir. Keytruda®, monoterapi olarak tümörde mikrosatellit instabilitesi yüksek (MSI-H) veya uyumsuzluk onarım eksikliği (dMMR) bulunan RAS yabanıl (wild) tip, ECOG PS 0-1 olan, erişkin metastatik kolorektal kanserde progresyona dek veya en fazla 35 siklus olarak birinci basamak tedavisinde endikedir. Hastalar eğer adjuvan tedavi almışlarsa 6 aydan uzun hastalıksız süre geçmiş olmalıdır. Keytruda®, ECOG PS 0-1, yüksek nüks riski olan (tümör boyutu ≥2 cm veya aksiller lenf bezi pozitif) lokal ileri/erken evre üçlü negatif meme kanserli yetişkinlerin tedavisinde neoadjuvan tedavi olarak antrasiklin ve karboplatinli kemoterapi ile kombinasyon halinde ve ardından cerrahi sonrası adjuvan tedavi devamı olarak monoterapi şeklinde nükse kadar veya maksimum 17 siklusa kadar endikedir. Keytruda®, valide edilmiş bir test ile PD-L1 (+) (CPS ≥ 10) olan, rezeke edilemeyen lokal olarak tekrarlamış veya metastatik üçlü negatif meme kanseri (TNBC)’nin birinci basamak tedavisinde kemoterapi ile kombine olarak endikedir. Hastalar eğer erken evrede adjuvan kemoterapi almışlarsa en az 6 aylık hastalıksız süre geçmiş olmalıdır. Keytruda®, önceki tedaviyi takiben progresyon gösteren ve alternatif tedavi seçenekleri olmayan, rezeke edilemeyen veya metastatik, MSI-H veya dMMR izlenen solid tümörlü yetişkin hastaların tedavisinde endikedir. Keytruda®, bevasizumab ile birlikte, paklitaksel ve sisplatin/karboplatin temelli kemoterapi ile kombinasyon halinde veya sadece paklitaksel ve sisplatin/karboplatin temelli kemoterapi ile kombinasyon halinde ve sonrasında idame olarak (progresyona dek veya maksimum 35 siklus), ECOG PS 0-1 ve tümörlerinde CPS≥ 1 ile PD-L1 eksprese eden küratif tedavi adayı olmayan persistan, tekrarlayan veya metastatik rahim ağzı kanseri tedavisi için endikedir. Keytruda®, monoterapi halinde, Evre IIB, IIC veya III deri malign melanomu olan ve tam rezeksiyon geçirmiş yetişkinlerin ve 12 yaş ve üzeri ergenlerin adjuvan tedavisi için endikedir. Adjuvan tedavi kullanım süresi 1 yıla kadardır. Hastalık nüksü ya da tolere edilemeyen toksisite gelişince tedavi sonlandırılmalıdır. Keytruda® monoterapi halinde, sisplatin içeren kemoterapi için uygun olmayan ve tümörleri kombine pozitif skor (CPS) ≥ 10 ile PD-L1 eksprese eden yetişkinlerde lokal olarak ilerlemiş veya metastatik ürotelyal karsinomun tedavisi için endikedir. Maksimum kullanım süresi iki yıla veya hastalık progresyonu ya da tolere edilemeyen toksisite gelişmesine kadardır. Keytruda®, monoterapi halinde, berrak hücreli renal karsinomu olan yetişkinlerin adjuvan tedavisi için aşağıda belirtilen risk faktörlerinden en az birini karşılayan hastalarda 1 yıl süreyle kullanımı endikedir:
-Patolojik evresi pT2N0M0 olup, grade 4 veya sarkomatoid özellikli olan hastalar
-Patolojik evresi pT3-4N0 olan ya da T evresinden bağımsız patolojik bölgesel nodal tutulumu olan herhangi grade hastalar
-M1 olup nefrektomi ve nefrektomiyle eş zamanlı ya da 1 yıl içinde komplet metastazektomi yapılan hastalar
Pozoloji/uygulama sıklığı ve süresi: Yetişkinlerde önerilen Keytruda® dozu, 30 dakika süresince intravenöz infüzyon şeklinde uygulanan 3 haftada bir 200 mg veya 6 haftada bir 400 mg’dır. 3 yaş ve üzeri cHL’li pediyatrik hastalarda monoterapi olarak önerilen Keytruda® dozu, 30 dakika süresince intravenöz infüzyon olarak uygulanan 3 haftada bir 2 mg/kg vücut ağırlığı (bw)’dır (maksimum 200 mg’a kadar). Hastalar Keytruda® ile hastalık progresyonuna veya kabul edilemez toksisiteye kadar tedavi edilmelidir. Atipik yanıtlar (örneğin; tümör büyüklüğünde başlangıçta geçici bir artış veya ilk birkaç ay içinde küçük yeni lezyonlar ve ardından tümörde küçülme) gözlenmiştir. Hastalık progresyonu doğrulanana kadar, başlangıçta hastalık progresyon kanıtı olan klinik açıdan stabil hastalar için tedaviye devam edilmesi önerilmektedir. Uygulama şekli: Keytruda® 30 dakika süresince intravenöz infüzyonla uygulanmalıdır. Keytruda® intravenöz yükleme veya bolus enjeksiyon şeklinde uygulanmamalıdır. Keytruda® kemoterapi kombinasyonu şeklinde uygulanacağı zaman önce Keytruda® uygulanmalıdır. Ayrıca birlikte uygulanan kemoterapi ajanlarının ürün bilgilerine de başvurunuz. Melanom veya RCC’nin adjuvan tedavisi için, KEYTRUDA hastalık tekrarlayana kadar, tolere edilemez toksisiteye kadar veya bir yıla kadar uygulanmalıdır. TNBC’nin neoadjuvan ve adjuvan tedavisi için hastalar, kemoterapi ile kombinasyon halinde neoadjuvan KEYTRUDA ile 3 haftada bir 200 mg 8 doz veya 6 haftada bir 400 mg 4 doz veya definitif cerrahiyi engelleyen hastalık progresyonuna veya kabul edilemez toksisiteye kadar tedavi edilmelidir, ardından adjuvan tedavi olarak KEYTRUDA monoterapi şeklinde 3 haftada bir 200 mg 9 doz veya 6 haftada bir 400 mg 5 doz veya hastalık tekrarlayana veya kabul edilemez toksisiteye kadar verilmelidir. Kemoterapi ile kombinasyon halinde neoadjuvan tedavi olarak KEYTRUDA ile ilgili definitif cerrahiyi engelleyen hastalık progresyonu veya kabul edilemez toksisite yaşayan hastalar, adjuvan tedavi olarak KEYTRUDA monoterapisini almamalıdır. Keytruda® dozunun azaltılması önerilmez, advers reaksiyonları yönetmek için Keytruda® tedavisine ara verilmeli veya kesilmelidir. Tedaviye bağlı toksisite son Keytruda® dozundan sonra 12 hafta içerisinde derece 0-1’e geri dönmezse veya 12 hafta içerisinde kortikosteroid dozunun günde 10 mg veya daha az prednizon ya da eşdeğerine düşürülememesi durumunda, Keytruda® tedavisi kalıcı olarak bırakılmalıdır. Daha önce immün sistem ile ilişkili miyokardit geçiren hastalarda pembrolizumab tedavisinin yeniden başlatılmasının güvenliliği bilinmemektedir. Keytruda® tedavisi derece 4 veya tekrarlayan derece 3 advers reaksiyonlar için kalıcı olarak bırakılmalıdır. Derece 4 hematolojik toksisite için, yalnızca cHL’li hastalarda, advers reaksiyonlar derece 0-1’e dönene kadar Keytruda® tedavisine ara verilmelidir. RCC’de aksitinib ile kombinasyon halinde: KEYTRUDA aksitinib ile kombinasyon halinde KEYTRUDA ile tedavi edilen RCC hastaları için, aksitinib dozuna ilişkin bilgi için KÜB’e bakınız. Pembrolizumab ile birlikte kullanıldığında, aksitinib dozunun başlangıç 5 mg dozunun üzerine çıkarılması, 6 hafta veya daha uzun aralıklarla düşünülebilir (bkz. bölüm 5.1). Aksitinib ile kombinasyon halinde KEYTRUDA ile tedavi edilen RCC hastalarında karaciğer enzim yükselmeleri için: • Eğer toplam bilirubin ≥ 2 kat ÜNL olmadan ALT veya AST ≥ 3 kat ÜNL ancak < 10 kat ÜNL ise, hem KEYTRUDA hem de aksitinibe, bu advers reaksiyonlar derece 0-1’e dönene kadar ara verilmelidir. Kortikosteroid tedavisi düşünülebilir. Tek bir ilaçla yeniden tedavi veya iyileşme sonrasında her iki ilaçla ardışık olarak yeniden tedavi düşünülebilir. Aksitinib ile yeniden tedaviye başlanıyorsa, aksitinib KÜB’üne göre doz azaltılması düşünülebilir. • Eğer ALT veya AST ÜNL değerinin 10 veya daha fazla katı veya ÜNL > 3 katı ve eşzamanlı olarak total bilirubin ≥ 2 katı ÜNL ise hem KEYTRUDA hem de aksitinib kalıcı olarak kesilmelidir ve kortikosteroid tedavisi düşünülebilir. Keytruda® ile tedavi edilen hastalara Hasta Uyarı Kartı verilmeli ve Keytruda®’nın riskleri konusunda bilgilendirilmelidir. Tedavi, kanser tedavisinde uzman hekimler tarafından başlatılmalı ve onların gözetimi altında verilmelidir. Hastalar KHDAK tedavisine başlamadan sigarayı bırakmaları konusunda teşvik edilmelidir. Endikasyonda belirtilmişse, PD-L1’in tümör ekspresyonuna dayalı olarak Keytruda® tedavisi için hasta seçimi, geçerliliği gösterilmiş bir testle yapılmalıdır. Monoterapi olarak Keytruda® ile tedavi için CRC’li hastaları seçerken, geçerliliği gösterilmiş bir test kullanılarak MSI-H/dMMR tümör durumunun test edilmesi önerilir. Özel Kullanım Uyarıları ve Önlemleri: Biyoteknolojik tıbbi ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir. PD-L1 durumunun değerlendirilmesi: Tümörün PD-L1 durumu değerlendirilirken; yalancı negatif veya yalancı pozitif tayinleri en aza indirmek için geçerliliği gösterilmiş ve sağlam bir metodolojinin seçilmesi önemlidir. İmmün sistem ilişkili advers reaksiyonlar: Pembrolizumab alan hastalarda şiddetli ve ölümcül vakalar dahil immün sistem ilişkili advers reaksiyonlar ortaya çıkmıştır. İmmün sistem ilişkili advers reaksiyonlardan kuşkulanıldığında, etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için yeterli değerlendirmenin yapıldığından mutlaka emin olunmalıdır. Advers reaksiyonun şiddetine bağlı olarak pembrolizumab tedavisine ara verilmeli ve kortikosteroidler uygulanmalıdır. Derece ≤1’e iyileşme olduktan sonra, kortikosteroid azaltımına başlanmalı ve en az 1 ay devam edilmelidir. İmmün sistem ilişkili advers reaksiyonların kortikosteroid kullanımıyla kontrol edilemediği hastalarda yürütülen klinik çalışmaların sınırlı verilerine dayanarak, diğer sistemik immünsupresanların uygulanması düşünülebilir. Eğer advers reaksiyon derece ≤ 1 olarak kalırsa ve kortikosteroid dozu günde ≤ 10 mg prednizon veya eşdeğerine düşürülmüşse Keytruda®’nın son dozundan sonraki 12 hafta içinde pembrolizumaba tekrar başlanabilir. Replasman hormonlarıyla kontrol altında olan endokrinopatiler hariç, nüks eden herhangi bir derece 3 immün sistem ilişkili advers reaksiyon ve herhangi bir derece 4 immün sistem ilişkili advers reaksiyon toksisitesi durumunda pembrolizumab kalıcı olarak bırakılmalıdır. Pembrolizumab alan hastalarda immun sistem ilişkili pnömonit, kolit, hepatit, nefrit,deri advers reaksiyonları ve hipofizit, tip1 diabetes mellitus, diyabetik ketoasidoz, hipotiroidizm ve hipertiroidizmi içeren şiddetli endokrinopatiler, deri advers reakisyonlar, tranplantasyona bağlı advers reaksiyonlar, ve infüzyonla ilişkili advers reaksiyonlar gözlenmiştir. Klinik çalışmalarda veya pazarlama sonrası deneyimde klinik yönden anlamlı vakalar dahil diğer immün sistem ilişkili advers reaksiyonlar: üveit, artrit, miyozit, miyokardit, pankreatit, Guillain-Barré sendromu, miyastenik sendrom, hemolitik anemi, sarkoidoz, ensefalit, miyelit, vaskülit, sklerozan kolanjit, gastrit ve enfektif olmayan sistit, hipoparatiroidizm olarak bidirilmiştir. Pembrolizumab kemoterapi ile kombinasyon halinde, bireysel bazda potansiyel fayda/risk dikkatli bir şekilde değerlendirildikten sonra ≥75 yaşındaki hastalarda dikkatle kullanılmalıdır. Keytruda® ile tedavi, solid organ transplantasyonu yapılan hastalarda organ reddi riskini arttırabilir. Bu hastalarda pembrolizumab tedavisi faydası ile olası organ reddi riski karşılaştırılmalıdır. Önceki pembrolizumab maruziyetinden sonra allojenik hematopoetik kök hücre transplantasyonu (HKHT) uygulanan cHL hastalarında graft-versus-host-hastalığı (GVHD) ve hepatik okluziv hastalık (VOD) vakaları gözlenmiştir. Daha fazla veri elde edilinceye kadar, HKHT’nin potansiyel yararları ve nakille ilişkili komplikasyonların muhtemel artmış riski, vaka bazında dikkatli bir şekilde değerlendirilmelidir. Allojenik HKHT öyküsü olan hastalarda, pembrolizumab tedavisinden sonra fatal GVHD dahil akut GVHD bildirilmiştir. Transplantasyon prosedüründen sonra GVHD yaşayan hastalar pembrolizumab tedavisinden sonra daha yüksek GVHD riskine maruz kalabilirler. Allojenik HKHT öyküsü olan hastalarda pembrolizumab tedavisinin yararı muhtemel GVHD riskiyle karşılaştırılmalıdır. Pembrolizumab alan hastalarda hipersensivite ve anafilaksiyi de içeren, infüzyonla ilişkili şiddetli reaksiyonlar bildirilmiştir. Derece 3 veya 4 infüzyon reaksiyonlarında infüzyon durdurulmalı ve pembrolizumab kalıcı olarak bırakılmalıdır. Derece 1 veya 2 infüzyon reaksiyonu olan hastalar yakın takip altında pembrolizumab almaya devam edebilirler; antipiretik ve antihistaminik ilaçlarla ön tedavi düşünülebilir. Özel Popülasyonlara İlişkin Ek Bilgiler: Pediatrik popülasyon: Keytruda®’nın güvenlilik ve etkililiği, cHL’li pediyatrik hastalar hariç, 18 yaşından küçük çocuklarda henüz belirlenmemiştir. Böbrek yetmezliği: Hafif veya orta derecede böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Keytruda® şiddetli böbrek yetmezliği olan hastalarda çalışılmamıştır. Karaciğer yetmezliği: Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Keytruda® orta derecede veya şiddetli karaciğer yetmezliği olan hastalarda çalışılmamıştır. Geriyatrik popülasyon: Yaşlı hastalarda (≥65 yaş) doz ayarlaması gerekli değildir. İstenmeyen Etkiler: Monoterapi- Çok yaygın (≥1/10); Anemi, hipotiroidizm, iştah azalması, baş ağrısı, dispne, öksürük, diyare, abdominal ağrı, bulantı, kusma, konstipasyon, döküntü, kaşıntı, kas-iskelet ağrısı, artralji, yorgunluk, asteni, ödem, ateş. Yaygın (≥1/100 ila <1/10); Pnömoni, trombositopeni, nötropeni, lenfopeni, infüzyonla ilişkili reaksiyon, hipertiroidizm, hiponatremi, hipokalemi, hipokalsemi, insomnia, baş dönmesini içeren sersemlik hali, periferik nöropati, letarji, tat alma duyumunda bozulma, göz kuruluğu, kardiyak aritmi (atriyal fibrilasyon dahil), hipertansiyon, pnömonit, kolit, ağız kuruluğu, hepatit, şiddetli deri reaksiyonları, eritem, dermatit, vitiligo, deride kuruluk, alopesi, egzama, akneiform dermatit, miyozit , ekstremite ağrısı, artrit, grip benzeri hastalık, üşüme, alanin aminotransferaz artışı, aspartat aminotransferaz artışı, hiperkalsemi, kanda alkalen fosfataz artışı, kanda kreatinin artışı, kanda bilirubin artışı. Kemoterapi ile kombinasyon- Çok yaygın (≥1/10); Nötropeni, anemi, trombositopeni, lökopeni, hipotiroidizm, hipokalemi, iştah azalması, insomnia, baş dönmesini içeren sersemlik hali, periferik nöropati, baş ağrısı, tat alma duyusunda bozulma, dispne, öksürük, diyare, bulantı, kusma, konstipasyon, abdominal ağrı, döküntü, alopesi, kaşıntı, kas-iskelet ağrısı, artralji, miyozit, yorgunluk, asteni, ödem, ateş, alanin aminotransferaz artışı, aspartat aminotransferaz artışı. Yaygın (≥1/100 ila <1/10); Pnömoni, febril nötropeni, lenfopeni, infüzyonla ilişkili reaksiyon, adrenal yetmezlik, tiroidit, hipertiroidizm, hiponatremi, hipokalsemi, letarji, göz kuruluğu, kardiyak aritmi (atriyal fibrilasyon dahil), hipertansiyon, pnömonit, kolit, ağız kuruluğu, gastrit, hepatit, şiddetli deri reaksiyonları, eritem akneiform dermatit, deride kuruluk, egzama, ekstremite ağrısı, artrit, akut böbrek hasarı, grip benzeri hastalık, üşüme, kanda bilirubin artışı, hiperkalsemi, kan kreatinin artışı kan alkalen fosfataz artışı. Aksitinib ile kombinasyon Çok yaygın (≥1/10); Hipertiroidizm, hipotiroidizm, iştah azalması, baş ağrısı, tat alma duyusunda bozulma (disguzi), hipertansiyon,dispne, öksürük, disfoni, diyare, bulantı, kusma, kabızlık, abdominal ağrı, Palmar plantar eritrodizestezi sendromu, döküntü, kaşıntı, kas-iskelet ağrısı, artralji, ekstremite ağrısı, yorgunluk, asteni, ateş, alanin aminotransferaz artışı, aspartat aminotransferaz artışı, kan kreatinin artışı. Yaygın (≥1/100 ila <1/10); Pnömoni, anemi, nötropeni, lökopeni, trombositopeni, infüzyonla ilişkili reaksiyon, hipofizit, tiroidit, adrenal yetmezlik, hipokalemi hiponatremi, hipokalsemi, insomnia, baş dönmesi, letarji periferik nöropati, göz kuruluğu, kardiyak aritmi(atriyal fibrilasyon dahil), pnömonit, kolit, ağız kuruluğu, hepatit, şiddetli deri reaksiyonları, akneiform dermatit, dermatit, deride kuruluk, alopesi, egzama, eritem, miyozit, artrit, tenosinovit, akut böbrek hasarı, nefrit, ödem, gribe benzer hastalık, üşüme, kan alkalen fosfataz artışı, hiperkalsemi, kan bilirubin artışı. Diğer Tıbbi Ürünlerle Etkileşimler ve Diğer Etkileşim Şekilleri: Pembrolizumab ile hiçbir resmi farmakokinetik ilaç etkileşim çalışması yürütülmemiştir. Pembrolizumab dolaşımdan katabolizma yoluyla uzaklaştırıldığından, metabolik ilaç etkileşimleri beklenmemektedir. Pembrolizumaba başlamadan önce sistemik kortikosteroidlerin veya immün supresanların kullanımından kaçınılmalıdır; çünkü, bunların pembrolizumabın farmakodinamik aktivitesi ve etkililiği ile etkileşim potansiyeli mevcuttur. Ancak pembrolizumaba başlandıktan sonra, immün sistem ilişkili advers reaksiyonları tedavi etmek için sistemik kortikosteroidler veya diğer immün supresanlar kullanılabilir. Pembrolizumab kemoterapiyle kombine kullanıldığında kortikosteroidler premedikasyon olarak, antiemetik profilaksi şeklinde ve/veya kemoterapiyle ilişkili advers reaksiyonları hafifletmek amacıyla da kullanılabilir. Kontrendikasyonlar: Etkin maddeye veya yardımcı maddelerden (L-histidin, L-histidin hidroklorür monohidrat, polisorbat-80, sukroz, enjeksiyonluk su) herhangi birine aşırı duyarlılıkta kullanılmamalıdır. Gebelik ve laktasyonda kullanım: Gebelik kategorisi D’dir. Gebe kadınlarda pembrolizumabın kullanımına ilişkin hiçbir veri yoktur. Kadının klinik durumu pembrolizumab tedavisini mutlaka gerektirmedikçe pembrolizumab gebelik döneminde kullanılmamalıdır. Pembrolizumabın anne sütüne geçip geçmediği bilinmemektedir. Antikorların anne sütüne geçtiği bilindiğinden, yenidoğanlara/bebeklere yönelik risk dışlanamaz. Emzirmenin çocuk açısından yararı ve pembrolizumab tedavisinin kadın açısından yararı dikkate alınarak emzirme veya pembrolizumab tedavisinden hangisinin kesileceğine karar verilmelidir. Üreme potansiyeli olan kadınlar pembrolizumab tedavisi süresince ve pembrolizumabın son dozundan sonra en az 4 ay süreyle etkili bir doğum kontrol yöntemi kullanmalıdır. Üreme yeteneği/Fertilite: Pembrolizumabın fertilite üzerindeki muhtemel etkilerine ilişkin hiçbir klinik veri yoktur. Araç ve makine kullanımı üzerine etkisi: Pembrolizumab araç ve makine kullanımı üzerinde hafif bir etki gösterebilir. Pembrolizumab uygulandıktan sonra yorgunluk ve baş dönmesini içeren sersemlik hali bildirilmiştir. Hastalar pembrolizumab aldıktan sonra kendilerini iyi hissettiklerinden emin olmadıkça araç veya makine kullanmamalıdır. Doz Aşımı ve tedavisi: Pembrolizumab ile doz aşımı hakkında hiçbir bilgi yoktur. Doz aşımı durumunda, hastalar advers reaksiyonların belirti ve bulguları yönünden yakından izlenmeli ve uygun semptomatik tedavi uygulanmalıdır. Saklama Koşulları: Buzdolabında 2°C – 8°C’de saklayınız. Işıktan korumak için orijinal karton ambalajında saklayınız. Dondurmayınız. İnfüzyon hazırlandıktan sonra mikrobiyolojik açıdan ürün seyreltildikten hemen sonra kullanılmalıdır. Seyreltilen ürün dondurulmamalıdır. Hemen kullanılmadığında, Keytruda®’nın kimyasal ve fiziksel stabilitesinin 2-8°C’de 96 saat devam ettiği gösterilmiştir. Bu 96 saatlik süre 6 saate kadar oda sıcaklığında (25°C veya daha düşük sıcaklıkta) saklamayı içerebilir. Eğer buzdolabında saklanırsa, flakonlar ve/veya intravenöz infüzyon torbalarının kullanımdan önce oda sıcaklığına ulaşması beklenmelidir. KEYTRUDA’yı çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Raf Ömrü: Açılmamış flakon 24 ay. Keytruda®’nın Sosyal güvenlik kurumu tarafından geri ödemesi yoktur. Ruhsat Sahibi: Merck Sharp Dohme İlaçları Ltd. Şti. Esentepe Mah. Büyükdere Cad. No:199 Levent 199 Ofis Blok Kat:13 Levent 34394 İstanbul Tel: (0212) 336 10 00 Fax: 0212 355 83 85. Ruhsat Tarihi ve Numarası: 06.06.2016 2016/467 Ruhsat yenileme tarihi:17.06.2021 DAHA GENİŞ BİLGİ İÇİN FİRMAMIZA BAŞVURUNUZ. Reçete ile satılır. Ticari formlarının KDV dâhil perakende satış fiyatı ve fiyatın onay tarihi: Keytruda®100 mg/4 ml intravenöz infüzyonluk çözelti. 66.083,92 TL 25.10.2024 KÜB’ün Yenilenme Tarihi: 17.01.2025 KÜB Özeti Güncelleme Tarihi: 20.01.2025


eTNBC bakımında multimodal bir yaklaşım artık mümkün
Erken evre üçlü negatif meme kanseri (eTNBC) hastaları artık KEYTRUDA® kombinasyon tedavisi ile multimodal bir yaklaşımdan yararlanabilir
Uygun niteliklere sahip evre lIB ve IC melanom hastalarınız için KEYTRUDA®’nın faydalarını keşfedin
KEYNOTE-716 nihai DMFS analizindeki son gelişmeleri keşfedin.
Referanslar:
1. KEYTRUDA®. Prescribing Information. 2. Choueiri TK, Tomczak P, Park SH, et al. Adjuvant Pembrolizumab after Nephrectomy in Renal-Cell Carcinoma. N Engl J Med. 2021;385(8):683-94. 3. Powles T, Albiges L, Bex A, et al. Renal cell carcinoma: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024;35(8):692-706. 4. Opdivo®. Prescribing Information. 5. Libtayo®. Prescribing Information. 6. Jemperli®. Prescribing Information. 7. Tecentriq®. Prescribing Information. 8. Bavencio®. Prescribing Information. 9. Imfinzi®. Prescribing Information. 10. Yervoy®. Prescribing Information. 11. Avastin®. Prescribing Information. 12. Ljungberg B, Bex A, Albiges L, et al. EAU Guidelines. Edn. presented at the EAU Annual Congress Paris 2024. ISBN 978-94-92671-23-3. 2024. 13. Referenced with permission from the NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) for Kidney Cancer V.1.2025. © National Comprehensive Cancer Network, Inc. 2025. All rights reserved. Accessed 17th January 2025. To view the most recent and complete version of the guideline, go online to NCCN.org. 14. Powles T, Tomczak P, Park SH, et al. Pembrolizumab versus placebo as post-nephrectomy adjuvant therapy for clear cell renal cell carcinoma (KEYNOTE-564): 30-month follow-up analysis of a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2022;23(9):1133-44. 15. Guideline on the clinical evaluation of anticancer medicinal products. European Medicines Agency Committee for Medicinal Products for Human Use. Accessed 17th January 2025. Available at: ema.europa.eu/en/documents/scientificguideline/guideline-clinical-evaluation-anticancer-medicinal-products-revision-6_en.pdf. Accessed 17th January 2025. 16. National Cancer Institute. Dictionary of Cancer Terms. DFS. Available at: https://www.cancer.gov/publications/dictionaries/cancer-terms/def/dfs. Accessed 17th January 2025. 17. Choueiri TK, Tomczak P, Park SH, et al. Overall Survival with Adjuvant Pembrolizumab in Renal-Cell Carcinoma. N Engl J Med. 2024;390(15):1359-71.
TR KEY-00707 | Expiry date: 28-11-2026